Le microbiome intestinal et la santé : Perspectives naturopathiques
Le tractus gastro-intestinal (TGI) humain contient à lui seul 10¹⁴ microorganismes incluant des bactéries, des virus, et des levures[1]. Cela représente à peu près 100 fois plus de cellules microbiennes que le nombre de cellules qui constituent le corps humain[2].
On comprend donc à quel point ces microorganismes peuvent affecter la santé humaine. Le terme que l’on utilise pour décrire l’ensemble des microorganismes que l’on trouve dans un environnement est « microbiote »[3]. L’environnement dans lequel ces organismes vivent est appelé le « microbiome »[4] — dans cet article, il est question de celui du TGI humain. Les humains et les microorganismes ont évolué ensemble au fil du temps, formant une relation symbiotique et mutuellement bénéfique[5]. Le microbiote intestinal confère un certain nombre de bienfaits. Il assure notamment le maintien de l’intégrité de la muqueuse du TGI, mais aussi la production de vitamines et de nutriments ainsi que la régulation du système immunitaire[6]. Il existe dans le TGI un équilibre optimal, et toute perturbation de cet équilibre peut déclencher une panoplie de symptômes, car certains microorganismes peuvent avoir des effets néfastes sur le corps et peuvent contribuer au développement de maladies[7] ; cela s’appelle la « dysbiose »[8].
Les maladies reliées à une dysbiose intestinale
Maladies inflammatoires des intestins (MII)
Le terme « maladies inflammatoires des intestins » (MII) fait référence à un groupe de maladies dont les deux formes principales sont la maladie de Crohn et la colite ulcéreuse. Dans ces deux pathologies, une inflammation résultant de lésions du TGI entraîne des douleurs abdominales, des carences en nutriments, et une morbidité générale. La dysbiose peut être à la fois la cause et le résultat d’une MII.[9]
En cas de MII, le système immunitaire devient extrêmement agressif au sein de l’appareil digestif et attaque un plus grand nombre de microorganismes ; les personnes atteintes de MII ont en effet une moindre diversité microbienne.[10] Les microorganismes protecteurs, comme les Bifidobacteria et les Clostridia, sont alors en quantités réduites, tandis que les espèces pathogènes comme les Proteobacteria et certaines souches d’Escherichia coli augmentent[11]. Ces dernières stimulent encore plus l’inflammation et activent des réponses immunitaires qui déclenchent des maladies[12].
Dépression
L’axe cerveau–intestins–microbiote est bidirectionnel[13]. Le cerveau communique avec les intestins, et à l’inverse, les microbes intestinaux peuvent communiquer avec le cerveau[14]. La voie de communication centrale passe par le nerf vague, qui connecte directement le TGI au cerveau[15]. L’inflammation est un symptôme de la dépression qui peut altérer le fonctionnement de la barrière intestinale ainsi que le microbiote[16]. Par rapport aux personnes non dépressives, les patients souffrant de dépression ont un microbiote perturbé, avec des niveaux réduits de bactéries bénéfiques[17]. Cette dysbiose contribue à renforcer les symptômes de la dépression, notamment du fait que les bactéries pathogènes qui communiquent avec le cerveau sont proinflammatoires[18], et ainsi, le cycle pathogène se poursuit.
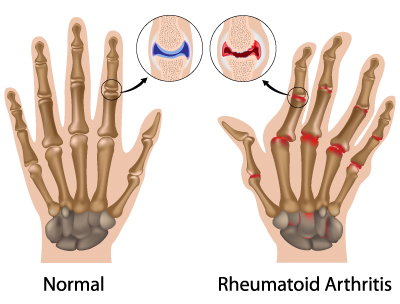 Arthrite rhumatoïde
Arthrite rhumatoïde
L’arthrite rhumatoïde est une maladie auto-immune, car le système immunitaire attaque les propres cellules du corps, en l’occurrence au niveau des articulations[19]. Étant donné que des marqueurs auto-immuns, comme le facteur rhumatoïde et les anticorps antiprotéines citrullinés, sont présents dans le sang bien avant que l’inflammation des articulations ne se fasse sentir, certaines théories avancent que l’auto-immunité pourrait provenir du TGI ou de la muqueuse pulmonaire[20]. Il a en effet été démontré qu’une réponse inflammatoire disproportionnée était déclenchée par une dysbiose intestinale, car certaines bactéries stimulent des cellules immunitaires autoréactives[21].
Diabète sucré de type 1
Le diabète sucré de type 1 est une maladie auto-immune qui entraîne la destruction des cellules bêta du pancréas. Il en résulte une absence de sécrétion d’insuline, qui affecte la régulation du glucose. En général, cette maladie apparaît pendant l’enfance. Comme nous l’avons vu avec l’arthrite rhumatoïde, la dysbiose intestinale affecte le système immunitaire. Certaines bactéries pathogènes contiennent une endotoxine, appelée lipopolysaccharide (LPS), qui stimule la réponse inflammatoire et compromet le fonctionnement des cellules bêta du pancréas[22]. Certaines études ont montré que chez les personnes atteintes d’un diabète de type 1, les quantités de LPS en circulation sont plus importantes que chez les personnes non diabétiques[23].
La LPS peut également porter atteinte à la muqueuse intestinale, ce qui provoque encore plus d’inflammation et accentue l’exposition à des antigènes environnementaux. Cela provoque ensuite l’activation du système immunitaire, alors même qu’il est déjà réactif[24]. Dans le diabète de type 1, la diversité et la stabilité intestinales sont réduites en comparaison avec des personnes non diabétiques[25]. Selon certaines hypothèses, cette faible diversité pourrait limiter la capacité à digérer des aliments variés, ce qui contribue à réduire encore plus le microbiote et à entraîner le développement de maladies[26].
Une approche naturopathique pour la dysbiose intestinale
Probiotiques
En ce qui concerne les maladies précédemment mentionnées, les probiotiques constituent un choix de thérapie approprié pour atténuer les symptômes liés à la dysbiose. Toutefois, avant de prendre des probiotiques, il est important de consulter un praticien de soins de santé, comme un naturopathe, car tous les probiotiques ne fonctionnent pas de la même façon.
Dans le traitement de la colite ulcéreuse, les probiotiques traditionnels jouent un rôle limité. Par contre, la souche spécifique E. coli Nissle ainsi que des souches propriétaires ont démontré leur efficacité pour maintenir la rémission et réduire l’inflammation[27]. Il existe également d’autres probiotiques spécifiques avec des effets bénéfiques pour les MII, notamment F. prausnitzii qui protège les intestins, entretient la barrière intestinale, et stimule la capacité du système immunitaire à nous protéger[28].
Afin de réduire les effets d’une dysbiose sur la dépression, on peut utiliser des psychobiotiques, qui sont une famille de probiotiques avec des effets positifs sur la santé mentale[29]. Plus largement, les psychobiotiques incluent les prébiotiques, des fibres alimentaires solubles qui nourrissent les bactéries intestinales[30]. Dans des études utilisant des psychobiotiques tels que le FOS et le BGOS (prébiotiques), une baisse du cortisol — l’hormone du stress qui constitue un marqueur d’anxiété et de dépression[31] — a été observée au réveil des participants. D’autre part, des souches spécifiques comme Bifidobacterium longum ont fait diminuer le cortisol matinal ainsi que les niveaux subjectifs d’anxiété, et ont également renforcé le fonctionnement cognitif[32].
 Les probiotiques affichent un excellent profil d’innocuité pour les personnes atteintes d’arthrite rhumatoïde[33]. Leurs effets sur la réduction de certaines cytokines proinflammatoires du système immunitaire, comme les IL-6, sont aujourd’hui avérés, mais ce n’est pas le cas pour d’autres marqueurs inflammatoires ou pour la douleur[34]. Il semblerait que les régimes riches en probiotiques, incluant notamment des aliments fermentés, des fibres alimentaires, et tout un ensemble de légumes, présentent des effets plus marqués sur les douleurs que les probiotiques pris sous la forme de suppléments[35].
Les probiotiques affichent un excellent profil d’innocuité pour les personnes atteintes d’arthrite rhumatoïde[33]. Leurs effets sur la réduction de certaines cytokines proinflammatoires du système immunitaire, comme les IL-6, sont aujourd’hui avérés, mais ce n’est pas le cas pour d’autres marqueurs inflammatoires ou pour la douleur[34]. Il semblerait que les régimes riches en probiotiques, incluant notamment des aliments fermentés, des fibres alimentaires, et tout un ensemble de légumes, présentent des effets plus marqués sur les douleurs que les probiotiques pris sous la forme de suppléments[35].
La recherche montre qu’une dysbiose est présente dans des maladies auto-immunes comme l’arthrite rhumatoïde, et que les probiotiques aident à rétablir le bon fonctionnement de la muqueuse ainsi qu’à réduire l’impact des bactéries nocives[36].
Cependant, les maladies auto-immunes sont multifactorielles, et d’autres aspects de ces maladies doivent être abordés. En combinaison avec d’autres ajustements — par exemple sur le mode de vie, l’alimentation, et la régulation des hormones — et avec des plantes médicinales, les probiotiques peuvent participer à la réussite du traitement.
Comme pour d’autres maladies auto-immunes, la muqueuse intestinale des personnes souffrant de diabète sucré de type 1 est compromise[37]. La recherche sur les probiotiques (spécifiques ou multisouches) pour traiter le diabète reste limitée ; néanmoins, les probiotiques peuvent restaurer la barrière intestinale ainsi que l’équilibre du microbiote. Par ailleurs, les prébiotiques et les glucides complexes fermentés par les bactéries intestinales produisent du butyrate, un acide gras à chaîne courte[38]. Le butyrate aide à maintenir l’intégrité intestinale, réduit la perméabilité des intestins, et est anti-inflammatoire, ce qui est particulièrement important pour traiter des affections auto-immunes[39].
Par ailleurs, certains indices suggèrent qu’un régime sans gluten pourrait être indiqué[40]. La maladie cœliaque, une autre maladie auto-immune qui implique la création d’autoanticorps contre le gluten, a été associée à d’autres maladies auto-immunes[41]. Un régime sans gluten pour les personnes atteintes de diabète de type 1 peut réduire le fardeau qui pèse sur le système immunitaire et peut en théorie prévenir le déclenchement de la maladie cœliaque[42].
Références
- Thursby, E., and N. Juge. “Introduction to the Human Gut Microbiota.” The Biochemical Journal, Vol. 474, No. 11 (2017): 1823–1836.
- Thursby and Juge, op. cit.
- Marchesi, J.R., et al. “The Gut Microbiota and Host Health: A New Clinical Frontier.” Gut, Vol. 65,No. 2 (2016): 330–339.
- Marchesi et al, op. cit.
- Thursby and Juge, op. cit.
- Thursby and Juge, op. cit.
- Marchesi et al, op. cit.
- Marchesi et al, op. cit.
- Sartor, R.B., and G.D. Wu. “Roles for Intestinal Bacteria, Viruses and Fungi in Pathogenesis of Inflammatory Bowel Disease and Therapeutic Approaches.” Gastroenterology, Vol. 152, No. 2 (2017): 327–339.e4.
- Sartor and Wu, op. cit.
- Sartor and Wu, op. cit.
- Sartor and Wu, op. cit.
- Dinan, T.G., and J.F. Cryan. “The Microbiome-Gut-Brain Axis in Health and Disease.” Gastroenterology Clinics of North America, Vol. 46, No. 1 (2017): 77–89.
- Dinan and Cryan, op. cit.
- Dinan and Cryan, op. cit.
- Dinan and Cryan, op. cit.
- Dinan and Cryan, op. cit.
- Dinan and Cryan, op. cit.
- Horta-Baas, G., et al. “Intestinal Dysbiosis and Rheumatoid Arthritis: A Link Between Gut Microbiota and the Pathogenesis of Rheumatoid Arthritis.” Journal of Immunology Research, Vol. 2017 (2017): 4835189.
- Horta-Baas et al, op. cit.
- Horta-Baas et al, op. cit.
- Han, H., et al. “Gut Microbiota and Type 1 Diabetes.” International Journal of Molecular Sciences, Vol. 19, No. 4 (2018): 995.
- Han et al, op. cit.
- Han et al, op. cit.
- Han et al, op. cit.
- Han et al, op. cit.
- Sartor and Wu, op. cit.
- Sartor and Wu, op. cit.
- Dinan and Cryan, op. cit.
- Dinan and Cryan, op. cit.
- Dinan and Cryan, op. cit.
- Dinan and Cryan, op. cit.
- Mohammed, A.T., et al. “The Therapeutic Effect of Probiotics on Rheumatoid Arthritis: A Systematic Review and Meta-Analysis of Randomized Control Trials.” Clinical Rheumatology, Vol. 36, No. 12 (2017): 2697–2707.
- Mohammed et al, op. cit.
- Mohammed et al, op. cit.
- Mohammed et al, op. cit.
- Harsch, I.A., and P.C. Konturek. “The Role of Gut Microbiota in Obesity and Type 2 and Type 1 Diabetes Mellitus: New Insights into ‘Old’ Diseases.” Medical Sciences, Vol. 6, No. 2 (2018): 32.
- Harsch and Konturek, op. cit.
- Harsch and Konturek, op. cit.
- Han et al, op. cit.
- Han et al, op. cit.
- Han et al, op. cit.
 Ann-Marie Regina, ND
Ann-Marie Regina, ND
Ann-Marie dispense à ses patients des soins de qualité afin qu’ils puissent vivre leur plein potentiel. Sa mission est de fournir des soins de santé personnalisés qui répondent aux besoins et désirs de ses patients, sans placer de limite sur ce qu’ils peuvent accomplir.

 Magasins
Magasins