L’axe microbiote-intestins-poumons : Une autoroute immunitaire bidirectionnelle
À l’heure actuelle, la plupart d’entre nous a déjà entendu le mot microbiote — l’ensemble constitué par des trillions de bactéries fonctionnelles de différentes espèces que l’on retrouve à divers endroits dans le corps comme la peau, les intestins, la bouche, le vagin, et les poumons. Que vous soyez un professionnel du monde médical ou simplement en train de regarder la télévision au moment où une pub pour du gel douche est diffusée, vantant les mérites de ce gel douche pour le microbiote cutané. D’une façon ou d’une autre, je suis sûre que vous en avez déjà entendu parler !
Dans la recherche, les médias spécialisés dans la santé et les professions médicales, le microbiote et son impact sur la santé sont considérés avec un grand intérêt, et ce à forte raison !
Notre microbiote intestinal remplit de nombreuses fonctions pour notre santé et affecte une multitude de systèmes dans notre corps : l’immunité, la production de neurotransmetteurs, la production de vitamines, la régulation des humeurs, la santé cérébrale, les niveaux d’inflammation, les concentrations de fer, les voies de transmission biochimiques, etc.
À présent, la recherche commence à accumuler des informations au sujet du microbiote pulmonaire et de l’axe poumons-intestins. Voyons de quoi il en retourne.
 On estime que le corps humain est habité par environ 38 trillions de bactéries [1], et que le côlon abriterait les populations de bactéries les plus denses et les plus actives sur le plan métabolique [2].
On estime que le corps humain est habité par environ 38 trillions de bactéries [1], et que le côlon abriterait les populations de bactéries les plus denses et les plus actives sur le plan métabolique [2].
Il a été démontré que le fait d’avoir des colonies de bactéries variées était indispensable pour la santé en général, et pas seulement la santé intestinale.
Un fait particulièrement intéressant dans le cadre de cet article est qu’un lien entre une diversité microbienne réduite et la prédisposition à des maladies allergiques des voies respiratoires a été établi dans des études [3]. Une réduction de l’activité microbienne peut être observée après une utilisation d’antibiotiques, chez les enfants souffrant de diarrhée infantile modérée à grave à répétition et en cas de malnutrition, pour ne citer que quelques exemples [4].
Des études ont également démontré un lien entre cette diversité réduite du microbiote intestinal et un risque accru de maladies des voies respiratoires comme l’asthme, ainsi qu’une plus forte prédisposition aux infections pulmonaires virales [3].
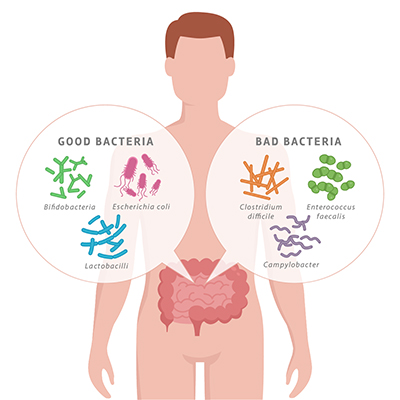 Le microbiote intestinal est influencé par l’alimentation, le stress, l’exercice, les infections, les médicaments, la nutrition, les conditions de digestion, les voyages, l’environnement et plus. Tous ces facteurs peuvent contribuer à une surpopulation d’espèces de bactéries nocives comparativement aux espèces bénéfiques, ou vice versa (en fonction du facteur).
Le microbiote intestinal est influencé par l’alimentation, le stress, l’exercice, les infections, les médicaments, la nutrition, les conditions de digestion, les voyages, l’environnement et plus. Tous ces facteurs peuvent contribuer à une surpopulation d’espèces de bactéries nocives comparativement aux espèces bénéfiques, ou vice versa (en fonction du facteur).
Cette surpopulation de bactéries nocives au détriment de bactéries bénéfiques s’appelle une dysbiose. Elle peut avoir un impact négatif sur la santé gastrointestinale ainsi que sur la santé globale. L’impact de cette dysbiose sur le système respiratoire présente un intérêt particulier.
Dans le passé, on a pu considérer les poumons comme un environnement stérile, mais nous savons désormais que ce n’est pas le cas [5]. Après sa formation initiale lors de nos premières respirations en tant que nouveau-nés, le développement du microbiote pulmonaire se ferait en partie à travers la respiration de colonies bactériennes par la bouche pendant notre sommeil, quand les muscles et les tissus de notre bouche, et de notre thorax, sont détendus et que notre respiration profonde pendant le sommeil achemine les microbes plus profondément dans notre arbre bronchique [5].
Ce microbiote pulmonaire est dynamique et, tout au long de notre vie, il est influencé par le microbiote intestinal, et vice versa [5]. Cette communication bidirectionnelle est désignée par les termes d’axe intestins-poumons et suscite un intérêt croissant dans le monde de la recherche.
Cette connexion intestins-poumons est bien illustrée par des données qui indiquent que 50 % des patients souffrant de maladies inflammatoires des intestins et de dysbiose ont également une fonction pulmonaire réduite [5].
En plus de cela, des études ont démontré que les infections respiratoires, comme par le virus influenza, peuvent entraîner une altération du microbiote intestinal et des problèmes gastro-intestinaux [5].
Cette boucle bidirectionnelle entre les intestins et les poumons qui influencent leur microbiote respectifs se fait principalement par le biais des bactéries qui agissent comme des molécules de signalement [6]. Nos bactéries intestinales jouent un rôle protecteur contre les infections pulmonaires bactériennes et virales, en régulant notre réponse immunitaire par la stimulation des cellules immunitaires dans le fluide lymphatique et la moelle osseuse [3].
 Les bactéries des intestins utilisent ce signalement pour stimuler les cellules immunitaires, qui vont ensuite voyager à travers les ganglions lymphatiques mésentériques dans les intestins, via le fluide lymphatique, et jusqu’au ganglions lymphatiques dans le système respiratoire où les informations immunologiques passent des intestins aux poumons et vice versa [6].
Les bactéries des intestins utilisent ce signalement pour stimuler les cellules immunitaires, qui vont ensuite voyager à travers les ganglions lymphatiques mésentériques dans les intestins, via le fluide lymphatique, et jusqu’au ganglions lymphatiques dans le système respiratoire où les informations immunologiques passent des intestins aux poumons et vice versa [6].
Les bactéries intestinales peuvent également influencer les bactéries pulmonaires de façon plus directe. Bien que les ganglions lymphatiques des intestins neutralisent la plupart des bactéries, les bactéries qui survivent ainsi que des fragments bactériens voyagent à travers le système lymphatique et atteignent la circulation générale, où ils peuvent alors moduler la réponse immunitaire dans les poumons [14]. Ce processus se produit également dans le sens opposé, des poumons aux intestins.
Nous voyons à présent comment les poumons et les intestins font partie de notre système immunitaire et comment une réponse inflammatoire, une infection ou une dysbiose dans l’un de ces organes peuvent être reflétés dans l’autre [6].
Un autre facteur important dans la modulation du système immunitaire par le biais du microbiote intestinal se fait par le biais des acides gras à courte chaîne (AGCC) [6]. Les bactéries intestinales digèrent des fibres alimentaires et produisent alors des métabolites appelés AGCC, comme par exemple du butyrate et du propionate. Ces AGCC remplissent des fonctions multiples dans nos corps : ils alimentent nos cellules intestinales pour les aider à se développer et à fonctionner, ils alimentent les mitochondries de notre corps afin qu’elles produisent de l’énergie, ils renforcent la paroi intestinale et ils ont des effets anti-inflammatoires dans les systèmes intestinal et respiratoire. Les AGCC contribuent à la structure de notre muqueuse intestinale par la fortification de ce qu’on appelle les jonctions serrées —, aidant ainsi à réduire la perméabilité intestinale [6]. Le butyrate (un AGCC) fonctionne également en stimulant le signalement anti-inflammatoire, ce qui peut réduire l’inflammation dans les intestins, notamment dans certains cas de cancer du côlon [6].
Ces AGCC exercent leurs bienfaits dans le système immunitaire des poumons en voyageant des intestins jusqu’au flux sanguin, et en atteignant la moelle osseuse où ils stimulent des effets en chaîne. Ces effets résultent en un métabolisme accru des cellules immunitaires, et sur l’activation de cellules immunitaires spécifiques qui exercent une activité antivirale dans les poumons [6].
Résumons toutes ces informations condensées.
La connexion entre nos intestins et nos poumons est complexe et bidirectionnelle. Une infection, une dysbiose ou une inflammation dans un organe se reflète dans l’autre (par ex : les MII et les dysbioses sont associées à une fonction pulmonaire réduite et le virus influenza cause des dysbioses intestinales et des problèmes gastro-intestinaux) [6].
Les bactéries et les métabolites des bactéries (AGCC) régissent cette connexion.
La communication entre les poumons et les intestins se produit à travers la circulation sanguine générale ou la circulation lymphatique, qui contiennent des AGCC (qui activent les cellules immunitaires et sont anti-inflammatoires), des informations immunologiques, des bactéries et des fragments bactériens [6].
Nous allons maintenant nous intéresser à quelques facteurs importants (pas tous !) à prendre en compte si l’on souhaite entretenir sa santé intestinale.
 Avant toute chose : suivez des conseils de nutrition, de supplémentation et de mode de vie qui vous conviennent et qui sont adaptés à votre corps.
Avant toute chose : suivez des conseils de nutrition, de supplémentation et de mode de vie qui vous conviennent et qui sont adaptés à votre corps.
Les informations en ligne — cet article inclus — ne devraient être utilisées qu’en tant que guide général. Votre santé repose sur des soins personnalisés et individualisés, alors n’hésitez pas à consulter un naturopathe pour résoudre vos problèmes.
Un régime sain, équilibré et riche en aliments complets, incluant des quantités de légumes de toutes sortes et de toutes les couleurs, est un pilier fondamental de notre santé intestinale.
Ne faites pas l’impasse sur les légumes riches en glucides ou en amidons. En évitant les légumes riches en glucides et en amidons, vous allez manquer de bactéries bénéfiques et très importantes, qui prospèrent grâce à ces types de légumes et à leurs fibres. Ces bactéries bénéfiques produisent ces AGCC très importants dont nous avons parlé, lors de la digestion de ces fibres.
Consultez un naturopathe pour vous assurer que votre régime est adapté à vos objectifs et à votre corps.
Le stress a un effet négatif sur la diversité et l’équilibre de notre microbiote. La gestion du stress est donc indispensable pour la santé intestinale. Votre naturopathe peut vous aider !
Évitez les aliments susceptibles de causer une dysbiose et des inflammations comme les sucres, les édulcorants artificiels, les aliments transformés, les céréales raffinées et d’autres aliments proinflammatoires que vous avez pu identifier comme étant des déclencheurs (essayez de les identifier avec l’aide de votre naturopathe).
 Les sources alimentaires prébiotiques (si votre système est capable de les gérer — elles pourraient aggraver certains problèmes) nourrissent les bactéries saines de vos intestins. Ces sources incluent la racine de gingembre entière, les oignons, l’ail cru et les bananes pas tout à fait mûres.
Les sources alimentaires prébiotiques (si votre système est capable de les gérer — elles pourraient aggraver certains problèmes) nourrissent les bactéries saines de vos intestins. Ces sources incluent la racine de gingembre entière, les oignons, l’ail cru et les bananes pas tout à fait mûres.
Si cela vous convient, les sources de probiotiques alimentaires ou en supplémentation introduisent des bactéries bénéfiques dans vos intestins. Encore une fois, faites appel aux conseils de votre naturopathe car ils peuvent éventuellement aggraver certains problèmes si on ne les utilise pas correctement.
 Dre Elena Zarifis, BSc.(Hons), ND
Dre Elena Zarifis, BSc.(Hons), ND
Docteure agréée en naturopathie d’Oakville et de Burlington en Ontario, elle se spécialise en santé intestinale, cérébrale, thyroïdienne et hormonale.
drelenaznd.com
Références
- Sender, R., S. Fuchs, and R. Milo. “Revised estimates for the number of human and bacteria cells in the body.” PLoS Biology, Vol. 14, No. 8 (2016): e1002533.
- Donaldson, G.P., S.M. Lee, and S.K. Mazmanian. “Gut biogeography of the bacterial microbiota.” Nature Reviews. Microbiology, Vol. 14, No. 1 (2016): 20–32.
- Dang, A.T., and B.J. Marsland. “Microbes, metabolites, and the gut–lung axis.” Mucosal Immunology, Vol. 12, No.4 (2019): 843–850.
- Rouhani, S., et al. “Diarrhea as a potential cause and consequence of reduced gut microbial diversity among undernourished children in Peru.” Clinical Infectious Diseases, Vol. 71, No. 4 (2020): 989–999.
- Wypych, T.P., L.C. Wickramasinghe, and B.J. Marsland. “The influence of the microbiome on respiratory health.” Nature Immunology, Vol. 20, No. 10 (2019): 1279–1290.
- Anand, S., and S.S. Mande. “Diet, microbiota and gut–lung connection.” Frontiers in Microbiology, Vol. 9 (2018): 2147.

 Magasins
Magasins